আয়নিক বা তড়িৎযোজী বা ইলেকট্রোভ্যালেন্ট বন্ধন কাকে বলে? (Ionic or Electrovalent Bond)
রাসায়নিক বিক্রিয়ায় এক পরমাণুর বহিস্তর থেকে অপর পরমাণুর বহিস্তরে এক বা একাধিক ইলেকট্রন স্থান্তারিত হয়ে যথাক্রমে ধনাত্মক ও ঋণাত্মক আয়ন সৃষ্টির মাধ্যমে উভয় পরমাণুর মধ্যে সৃষ্ট স্থিরবিদ্যুৎ আকর্ষণ শক্তি দ্বারা যে বন্ধন গঠিত হয় তাকে তড়িৎযোজী বন্ধন বা আয়নিক বন্ধন বা ইলেকট্রোভ্যালেন্ট বন্ধন বলে।
অথবা,
ইলেকট্রন আদান-প্রদানের মাধ্যমে গঠিত ক্যাটায়ন এবং অ্যানায়নসমূহ যে আকর্ষণ বল দ্বারা যৌগের অণুতে আবদ্ধ থাকে তাকে আয়নিক বন্ধন বলে।
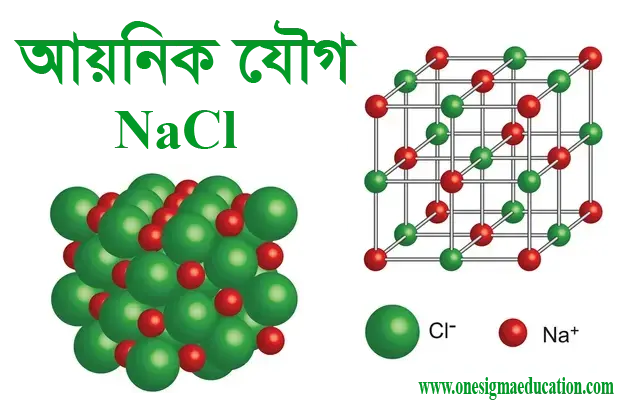
যেমন – NaCl এর মধ্যে Na ও Cl এর মধ্যকার বন্ধন আয়নিক বন্ধন। সুতরাং NaCl একটি আয়নিক যৌগ।
যে সব মৌলের মধ্যে তড়িৎ ঋণাত্মকতার ব্যাপক পার্থক্য রয়েছে এমন দুটি বিপরীতধর্মী মৌলের পরমাণুর মধ্যে তড়িৎযোজী বন্ধন গঠিত হয়। তড়িৎ ঋণাত্মকতার পার্থক্য বেশি হওয়ার জন্য এমন একটি মৌলকে হতে হয় তড়িৎ ধনাত্মক তথা ধাতু এবং অপর মৌলটি হয় তড়িৎ ঋণাত্মক তথা অধাতু।
তড়িৎ ধনাত্মক ধাতু তার বৈশিষ্ট্যের কারণে ইলেকট্রন ত্যাগ করে ধনাত্মক আয়নে পরিণত হওয়ার এবং বিপরীতক্রমে তড়িৎ ঋণাত্মক অধাতু ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হওয়ার প্রবণতা প্রকাশ করে। তাই এ ধরনের দুটি বিপরীতধর্মী মৌলের পরমাণু পরস্পরের সংস্পর্শে এলে স্থিতিশীল ইলেকট্রনীয় কাঠামো অর্জনের জন্য ধাতুর পরমাণুর বহিস্তর থেকে এক বা একাধিক ইলেকট্রন অধাতুর পরমাণুর বহিস্তরে স্থানান্তরিত হয়। ফলে দাতা পরমাণু ধনাত্মক আয়নে এবং গ্রহীতা পরমাণু ঋণাত্মক আয়নে পরিণত হয় এবং বিপরীত চার্জযুক্ত আয়নদ্বয় পরস্পর স্থির বিদ্যুৎ আকর্ষণ শক্তির সাহায্যে আকৃষ্ট হয়ে যুক্ত হয় ও অণু গঠন করে। আর অণু গঠনে সংশ্লিষ্ট এ স্থির বিদ্যুৎ আকর্ষণ শক্তিকেই বলে তড়িৎযোজী বন্ধন বা আয়নিক বন্ধন।
আয়নিক যৌগ কাকে বলে?
ইলেকট্রন বর্জন ও গ্রহন করে বিপরীত চার্জযুক্ত আয়ন সৃষ্টির মাধ্যমে পরস্পরের মধ্যে স্থির বৈদ্যুতিক আকর্ষণের ফলে দুটি পরমাণুর মধ্যে আয়নিক বন্ধন সৃষ্টির মাধ্যমে যে যৌগের সৃষ্টি হয় তাকে আয়নিক বন্ধন বলে।
অথবা,
আয়নিক বন্ধনে আবদ্ধ যৌগকে আয়নিক যৌগ বা তড়িৎযোজী যৌগ বলে। যেমন – NaCl একটি আয়নিক যৌগ। যখন সক্রিয় ধাতু Na এর সাথে সক্রিয় অধাতু Cl এর রাসায়নিক বিক্রিয়া ঘটে তখনই এই যৌগটি গঠিত হয়।
আয়নিক বন্ধন গঠনের শর্তসমূহ
আয়নিক বন্ধন গঠনের শর্তাবলি নিম্নে আলোচনা করা হলো:
১) আয়নিক বন্ধনে অংশগ্রহণকারী পরমাণুদ্বয়ের একটি তড়িৎ ধনাত্মক ধাতব পরমাণু এবং অপরটি তড়িৎ ঋণাত্মক অধাতব পরমাণু হওয়া আবশ্যক।
২) ধাতব পরমাণু আয়নিকরণ কম এবং অধাতব পরমাণুর ইলেকট্রন আসক্তি বেশি হওয়া উচিত।
৩) আয়নিক যৌগটির ল্যাটিস শক্তি উচ্চ হতে হবে।
৪) পরমাণুর সর্বশেষ স্তরটি অবশ্যই নিউক্লিয়াস থেকে যথাযথ দূরে অবস্থিত হতে হবে।
আয়নিক যৌগের বৈশিষ্ট্য
১) আয়নিক যৌগসমূহ পোলার বা মেরুক প্রকৃতির হয়।
২) আয়নিক যৌগসমূহ দানাদার বা কেলাসাকার প্রকৃতির হয়।
৩) আয়নিক যৌগের গলনাঙ্ক ও স্ফুটনাঙ্ক অত্যন্ত উচ্চ হয়। যেমন: আয়নিক যৌগ NaCl এর স্ফুটনাঙ্ক 1470℃ অথচ সমযোজী ক্লোরাইড CCl4 এর স্ফুটনাঙ্ক মাত্র 77℃।
৪) তড়িৎযৌজী যৌগসমূহ অপোলার দ্রাবকে দ্রবীভূত হয় না, কিন্তু পোলার দ্রাবকে অত্যন্ত দ্রবণীয়। যেমন: সোডিয়াম ক্লোরাইড পানিতে দ্রবণীয় কিন্তু CCl4 এ অদ্রবণীয়।
৫) আয়নিক যৌগসমূহ কঠিন অবস্থায় বিদ্যুৎ পরিবাহী নয়, কিন্তু দ্রবণে বা গলিত অবস্থায় বিদ্যুৎ পরিবাহী।